- VIH/Sida
- Orphelins du sida, orphelins et enfants vulnérables (OEV)
- Associations, Mobilisations
- Et en Afrique, on dit quoi ?
- Adoption internationale et nationale
- Psychologie géopolitique
- Justice internationale
- Zone Franche
- COVID-19
- Act Up Paris (49/289)
- Action militante (32/289)
- Activisme (73/289)
- Adoption (82/289)
- Afrique (161/289)
- Afrique du Sud (73/289)
- Alimentation, Faim (48/289)
- ARV (203/289)
- Associations, mobilisation communautaire (65/289)
- Bénin (13/289)
- Big Pharma (16/289)
- Botswana (9/289)
- Brevet (83/289)
- Burkina (18/289)
- Burundi (30/289)
- Cameroun (47/289)
- Centrafrique (23/289)
- Changements climatiques (10/289)
- Colonialisme, racisme (19/289)
- Conférence (118/289)
- Congo Brazzaville (24/289)
- Côte d’Ivoire (263/289)
- COVID-19 (13/289)
- CPI (48/289)
- CSAS (32/289)
- Dekens (29/289)
- Dépistage (19/289)
- Discrimination, Stigmatisation (131/289)
- Document (145/289)
- Documentaire (9/289)
- Droit (20/289)
- Droits humains (22/289)
- Enfants des rues (21/289)
- Enfants maltraités (10/289)
- Enfants soldats (68/289)
- Ethiopie (12/289)
- Ethnopsy (15/289)
- EVVIH (55/289)
- Film (22/289)
- Fonds mondial (48/289)
- Françafrique (39/289)
- France (289/289)
- Gabon (12/289)
- Génériques (59/289)
- Genre (22/289)
- Guerre, violences collectives (149/289)
- Guinée (12/289)
- Haïti (15/289)
- Handicap (10/289)
- Histoire (49/289)
- Homosexualité, Homophobie (44/289)
- Humanitaire (47/289)
- Inde (34/289)
- JAIV (10/289)
- Jeunesse (21/289)
- Justice (65/289)
- Kenya (35/289)
- Liberia (25/289)
- Livre (62/289)
- Lois transmission intentionnelle (24/289)
- Malawi (11/289)
- Mali (21/289)
- Médecine (62/289)
- Médicament, Traitements (142/289)
- Memory box, travail de mémoire (11/289)
- Migrations - immigration, émigration (67/289)
- Milices (34/289)
- Minorités culturelles (15/289)
- Modalités d’accueil des OEV (58/289)
- MSF (54/289)
- Nigeria (27/289)
- OEV (269/289)
- OMD (26/289)
- ONU (58/289)
- ONUSIDA (44/289)
- Orphelin (112/289)
- Ouganda (29/289)
- Photographie (27/289)
- Pillage des ressources (77/289)
- Politiques (120/289)
- Prévention, réduction des risques (131/289)
- Prisons (22/289)
- Psy (119/289)
- PTME (12/289)
- PVVIH (111/289)
- RDC (104/289)
- Rwanda (23/289)
- Santé publique (59/289)
- Scolarisation (9/289)
- Sénégal (13/289)
- Sérophobie (19/289)
- SIDA (29/289)
- Sierra Leone (13/289)
- Somalie (12/289)
- Sorcellerie (19/289)
- Tchad (10/289)
- Togo (15/289)
- Torture (17/289)
- Travail (21/289)
- Unitaid (26/289)
- Vidéo (23/289)
- VIH (154/289)
- Zambie (12/289)
- Zimbabwe (21/289)
SIDA : quel accès aux médicaments dans les pays du sud ?Un résumé des enjeux et de la situation |
|
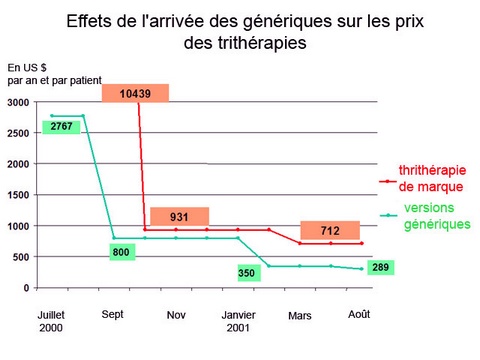
Un an après l’application des accords de l’OMC sur la propriété intellectuelle, qui empêchent les pays en développement de copier les nouveaux médicaments, le point sur l’accès aux antirétroviraux dans les pays du Sud. Aujourd’hui, seulement un malade sur dix en Afrique et un malade sur sept en Asie ont accès aux traitements contre le sida . Fin 2005, on comptait ainsi 1 million de malades traités sur les 6,5 millions qui en auraient besoin. Si l’accès aux médicaments a plus que doublé en l’espace de deux ans, l’objectif des « 3 millions de patients sous traitement d’ici 2005 », lancé par l’OMS en 2003, est encore loin d’être atteint... Les chiffres du sida en 2005Le rapport de l’Onusida publié fin novembre 2005 révèle que « le nombre de personnes vivant avec le VIH dans le monde a atteint son niveau le plus élevé jamais enregistré » : 40,3 millions de personnes contre 37,5 millions en 2003. Parmi elles, plus de dix millions ont entre 15 et 24 ans. Malgré de nombreuses campagnes de prévention réalisées depuis l’apparition du virus en 1981, près de cinq millions de personnes ont encore été infectées durant l’année 2005, « le nombre le plus élevé (en un an) depuis le début de l’épidémie » a relevé Peter Piot, le directeur exécutif de l’Onusida . Chaque jour, près de 14 000 personnes, dont 2 000 enfants de moins de 15 ans, sont ainsi infectées. Plus de 3 millions de personnes ont également succombé à la maladie durant l’année. Avec 25 millions de personnes décédées depuis 1981, il s’agit selon le rapport de « l’une des épidémies les plus dévastatrices de l’histoire ». Le problème des génériquesLes pays en développement membres de l’Organisation mondiale du commerce (OMC) avaient jusqu’au 1er janvier 2005 pour mettre en application les accords sur les aspects du droit de la propriété intellectuelle (ADPIC). Concrètement, cela signifie que ces pays ne peuvent plus copier et vendre les médicaments récents. Les nouvelles molécules seront protégées pendant vingt ans et le détenteur du brevet pourra les vendre au prix qu’il fixera lui-même. L’Inde fut un des derniers pays en développement à se conformer à ces accords. Premier exportateur de génériques au monde, ce pays ne peut donc plus produire de versions génériques des nouveaux médicaments. Conséquence de ces mises en conformité : les récents médicaments contre le sida dits de seconde ligne, c’est-à-dire ceux utilisés lorsque des résistances aux médicaments de première ligne apparaissent, ne pourront plus être concurrencés par des génériques. Leur coût élevé le rend donc inaccessibles aux pays pauvres qui, pourtant, voient eux-auusi apparaître des problèmes de résistances aux premiers traitements... Les grandes étapes du brevetage des médicamentsJusqu’en 1994, les pays étaient libres de respecter ou non la propriété intellectuelle dans le domaine pharmaceutique. Certains accordaient des brevets pour les inventions de produits pharmaceutiques, d’autres uniquement pour les procédés de fabrication, et d’autres encore n’accordaient aucune protection aux inventions de médicament. C’est ainsi qu’en Inde, en Chine ou encore au Brésil, une industrie de médicaments copiés, les génériques, a pu se développer, notamment pour les traitements antirétroviraux. Ces médicaments ont pu alors être vendus sur leur marché intérieur ou dans les pays pauvres à un prix défiant toute concurrence (400 dollars pour une trithérapie standard en générique contre 12 000 dollars pour la même trithérapie brevetée).
Mais en avril 1994, des négociations aboutissent aux accords sur les aspects du droit de la propriété intellectuelle (ADPIC ou TRIPS an anglais) qui imposent à tous les pays membre de l’OMC de respecter les protections par brevet des inventions de produits comme des inventions de procédés de fabrication. Dès lors, le détenteur d’un brevet dispose d’un monopole de vingt ans sur son produit. La date de mise en conformité a été fixée au 1er janvier 1995 pour les pays riches, au 1er janvier 2005 pour les pays en développement et en 2016 pour les pays les moins avancés. La licence obligatoire : une procédure trop complexeBenjamin Coriat, économiste de la santé (ANRS) : “Les difficultés juridiques et économiques des licences obligatoires font qu’aucun cas d’application n’a encore eu lieu“. Les accords sur la propriété intellectuelle de l’OMC offrent la possibilité aux pays pauvres d’accéder à des médicaments moins chers (en versions génériques) que ceux vendus par les détenteurs de brevets sur leur territoire. C’est ce qu’on appelle la licence obligatoire. Elle est envisageable « dans des situations d’urgence nationale ou d’autres circonstances d’extrême urgence ». Toutefois, la complexité de cette procédure est telle qu’aucun Etat depuis 2003 ne l’a utilisée. Elle impose notamment de ne produire le médicament qu’au coup par coup, selon la demande, ce qui rend impossible une fabrication à grande échelle. En avril 2005, les Etats africains ont déposé une demande de simplification de la procédure, mais ils n’ont toujours pas obtenu gain de cause... Publié sur OSI Bouaké le jeudi 15 décembre 2005
|
DANS LA MEME RUBRIQUE |
|||||
| |